Iako se razvijaju kroz posve različite biološke procese, rak i Alzheimerova bolest ubrajaju se među najstrašnije medicinske dijagnoze. Rak nekontrolirano raste, a Alzheimerova bolest oduzima pamćenje, malo po malo. Ipak, rijetko koja osoba ima obje te dijagnoze bolesti.
tri vijesti o kojima se priča


Epidemiolozi već dugo uočavaju zanimljiv obrazac. Osobe kojima je dijagnosticiran rak rjeđe razvijaju Alzheimerovu bolest, dok oboljeli od Alzheimerove bolesti rjeđe dobivaju rak. Justin Stebbing, profesor biomedicinskih znanosti na britanskom Sveučilištu Anglia Ruskin, ističe u članku za The Conversation da je tom opažanju nedostajalo uvjerljivo biološko objašnjenje, odnosno znanstveni dokaz.
Istraživanje na miševima
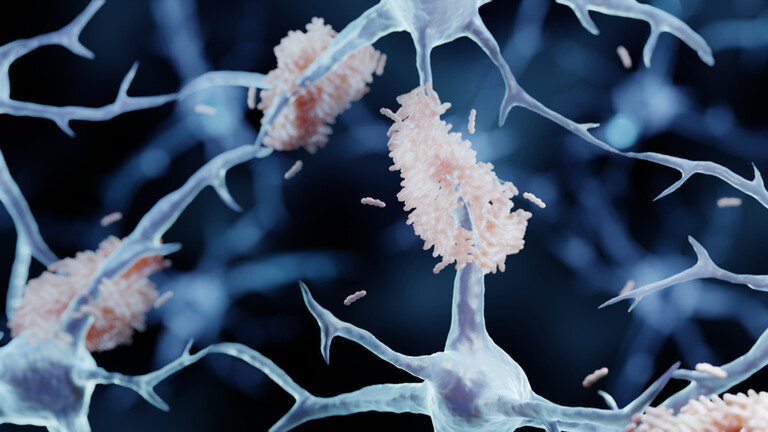
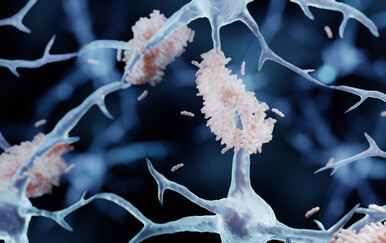
Stebbing u tom smislu ističe nedavno objavljeno istraživanje na miševima, koje upućuje na to da neki tumori odašilju signale koji se suprotstavljaju procesima koji dovode do razvoja Alzheimerove bolesti. Istraživanje, koje je objavljeno u časopisu Cell, usredotočuje se na amiloid betu, protein koji se nakuplja između neurona i stvara plakove koji remete prijenos signala, potiču upalu i narušavaju kognitivne sposobnosti.
Znanstvenici su miševima genetski programiranima za razvoj amiloidnih plakova pod kožu ugradili ljudske tumore pluća, prostate i debelog crijeva. Uobičajeno ti miševi s godinama stvaraju guste naslage. Kada su tumori bili prisutni, stvaranje plakova uglavnom je prestalo, a u nekim pokusima poboljšale su se i njihove sposobnosti pamćenja.
Mehanizam, objašnjava Stebbing, povezan je s cistatinom C, proteinom koji tumori otpuštaju u krvotok. U ovim je miševima cistatin C prešao krvno-moždanu barijeru i stupio u interakciju s ranim nakupinama amiloida.
Jednom kad se nađe u mozgu, cistatin C označava amiloid betu za uklanjanje putem mikroglije, imunoloških stanica mozga. U modelima Alzheimerove bolesti mikroglija obično ne uspijeva pratiti nakupljanje otpada. Cistatin C podrijetlom iz tumora aktivirao je receptor Trem2, preusmjerivši te stanice u učinkovitiji način čišćenja navedenih plakova.
Biološki kompromis
Stebbing naglašava da je riječ o biološkim kompromisima, u kojima štetni procesi u jednom kontekstu mogu imati neočekivane učinke drugdje. Nalazi se uklapaju u populacijska istraživanja koja pokazuju da obrnuti odnos raka i Alzheimerove bolesti ostaje prisutan i nakon prilagodbe prema dobi i zdravstvenim čimbenicima.
Ipak, treba biti i na oprezu. Kako Stebbing ističe, modeli na miševima oponašaju amiloidnu patologiju, ali ne i punu složenost ljudske demencije. Još nije jasno proizvode li ljudski tumori dovoljno cistatina C da bi utjecali na rizik od Alzheimerove bolesti.
Unatoč tome, implikacije su značajne. Navedeno istraživanje sugerira da bi terapije mogle oponašati djelovanje cistatina C ili aktivirati mikroglijalni Trem2 bez prisutnosti tumora. Stebbing pak zaključuje da proučavanje teških bolesti može otkriti strategije za zaštitu mozga u starijoj dobi te pokazati koliko su bolesti međusobno povezane. Takvi uvidi mijenjaju razumijevanje neurodegeneracije, imunoloških procesa i sustavnih interakcija bolesti u suvremenoj medicini.